脑小血管病(cerebral small vessel disease,CSVD)是指脑内微小血管病变导致的疾病,主要累及颅内小动脉、微动脉、毛细血管和小静脉等,在老年人中常见。随着年龄增长,CSVD发病率也随之升高,因症状隐匿而易被忽略,但是与认知功能障碍、脑卒中复发等密切相关。CSVD影像学上可显现为新近皮质下小梗死、腔隙性梗死灶(LI)、扩大的血管周围间隙(EPVS)、脑微出血(CMB)、脑白质高信号(WMH)和脑萎缩。PVS又称为Virchow Robin间隙,是脑实质内穿通动脉和流出静脉与周围软脑膜围绕形成的细小间隙,直径通常<3 mm,目前认为MRI上可见的PVS即为EPVS,且与脑脊液信号相似。EPVS走行与穿通血管一致,根据血管与MRI切面不同可呈现为圆形、椭圆形或条状。EPVS作为CSVD的一种影像学特征与其他影像学标志物如WMH和LI相关。近年来,随着PVS对组织液和代谢废物清除作用的研究不断深人,以及其对CSVD发病机制的理解认识不断提高,EPVS越来越受到人们的关注。
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea, OSA)是一种以睡眠期反复出现呼吸暂停低通气导致频繁发生低氧血症和睡眠结构紊乱为特征的睡眠呼吸障碍性疾病,其可并发心脑肺血管疾病,严重影响患者生活质量和寿命。大多数先前的研究都集中在OSA和WMH或LI的关系。少数文献报道OSA与EPVS之间的关系,然而结果亦不一致。
在本研究中,选取107名中青年参与者接受了视频多导睡眠监测、脑磁共振检查(MRI)和健康体检,并分为63名阻塞性睡眠呼吸暂停综合征(OSA)患者(轻度、中度和重度组)和44名健康对照组。评估了OSA患者的睡眠特征,量化了MRI得出的EPVS数量,并将其与多导睡眠描记获得的睡眠参数相关性进行分析。
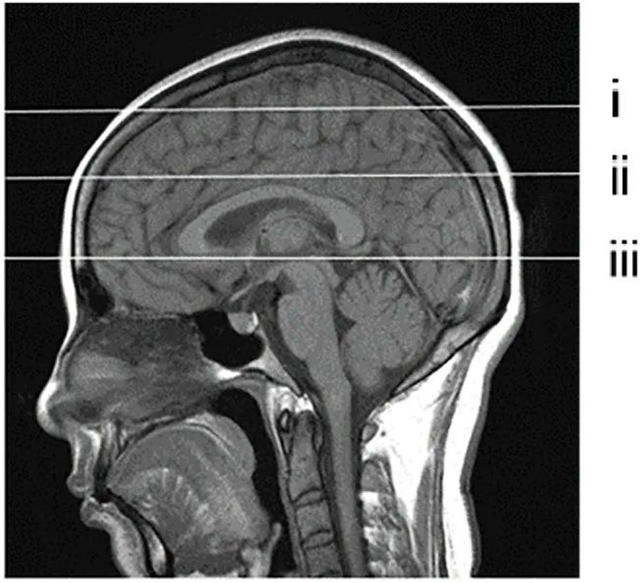
Selection of PVS observation layer shown in the sagittal view. (i) frontoparietal subcortical white matter layer; (ii) centrum semiovale layer; (iii) basal ganglia layer.
01 PSG参数研究结果
OSA主要导致睡眠潜伏期缩短,频繁觉醒、整夜睡眠片段化,浅睡眠延长,深睡眠及REM期睡眠缩短甚至消失。
02 EPVS的患病率和数目
我们的研究发现OSA组的EPVS患病率和数量均较健康对照组增加,为OSA和PVS之间的关系提供了证据。这种变化通过病理生理机制与OSA严重程度有关,导致脑血管疾病和认知能力下降。
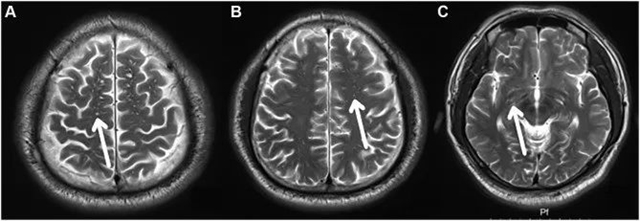
EPVS in OSA group observed at different layers. (A–C) display the frontoparietal subcortical white matter layer, centrum semiovale layer and basal ganglia layer; EPVS (white arrows).
03 呼吸参数与EPVS的相关性
人在睡眠时,大脑在觉醒过程中积累的神经毒性废物、垃圾将沿VRS中清除。睡眠质量下降会破坏神经毒素的去除,中断脑组织液的引流,导致VRS的扩大。我们的研究表明,呼吸参数 AHI、ODI 和 TS90% 与 EPVS 呈正相关关系,而 EPVS 和 LSaO2 呈显著的负相关。提示随着OSAHS严重程度的增加,睡眠时体内缺氧程度将不断加重、睡眠效率下降、睡眠片段化为PVS作为睡眠障碍期间血管清除率受损的标志提供了进一步的支持。
04 睡眠结构与EPVS的相关性
SE与EPVS呈显著负相关,AI与EPVS呈正相关。SE的降低可能与无效的PVS引流有关,可能导致PVS扩大。此外,大脑中蓝斑产生的去甲肾上腺素对促进觉醒有重要意义,它是调节类淋巴系统功能关键神经递质。去甲肾上腺素一方面直接作用于脉络丛上皮细胞,从而抑制脑脊液产生,也可引起软脑膜动脉收缩减少脑脊液流人,另一方面有可能增大细胞体积,进一步减少PVS体积分数,间接增加脑脊液流动阻力,最终影响类淋巴系统清除效率。此外,大脑内代谢产物清除有赖于星形胶质细胞终足水通道蛋白4的极性分布,长期睡眠剥夺或破碎影响AQP4的分布,使其失去极性而均匀排列在星形胶质细胞表面,进而影响类淋巴系统对代谢产物清除效率,导致PVS扩大。
进一步研究了不同睡眠阶段与 EPVS 的关系。发现EPVS与N3%和REM%呈负相关,但与N2%呈正相关。淋巴系统主要在睡眠期间活跃,其主要目的是通过血管周围系统清除组织间废物,以实现睡眠的稳态功能,然而这主要发生在慢波睡眠过程中,由活跃度低的慢脑电波触发或主导。在深度睡眠期间,这种排毒系统启动了高速运转模式,随着深度睡眠的脉动节律,大脑排出的废物多出10到20倍。同时,深度睡眠期大脑神经胶质细胞的体积缩小了60%,为脑脊液创造了更大的空间来清除代谢垃圾。然而,我们的结果表明,N2%与EPVS呈正相关,这可能为ISF清除主要发生在慢波睡眠期间的理论提供额外的支持。REM睡眠不足会伴有脑脊液的淋巴循环减少,继而导致脑积水,推测VRS可能与REM睡眠缺乏产生的病理性大脑状态发生了机械联系有关。
总结
EPVS严重程度随着OSA睡眠障碍的增加而加剧,表明OSA的严重程度可能受许多病理生理机制的调节,并影响大脑结构的改变,从而导致脑血管疾病。因此,OSA患者EPVS数量的增加是OSA患者卒中风险增加的潜在因素。
参考文献:[1] Jia Y , Liu C , Li H , et al. Enlarged Perivascular Space and Its Correlation with Polysomnography Indicators of Obstructive Sleep Apnea[J]. Nature and Science of Sleep, 2021, Volume 13:863-872.





